UN NUOVO PARADIGMA IN MEDICINA
Basi scientifiche
Fondamenti di metodologia
Ricerca pre-clinica e clinica
Per minima ad maxima
La Physiological Regulating Medicine (PRM) nasce dall’incontro tra la Biologia Molecolare e la Psico-Neuro-Endocrino-Immunologia (P.N.E.I.), e si è sviluppata grazie ai risultati della Ricerca nel campo della farmacologia dei bassi dosaggi.
La PRM è una Medicina centrata sulla persona, fondata su 3 principi guida:
- curare l’uomo e non solo la malattia;
- agire sulle cause e non solo sui sintomi;
- considerare l’uomo nella sua globalità mente-corpo e nella sua individualità.
La PRM prende le mosse da un’idea originale in campo medico: riportare alle condizioni fisiologiche di partenza un organismo ammalato attraverso l’utilizzo delle stesse molecole biologiche presenti normalmente nell’organismo e che, in condizioni di salute, ne controllano e guidano le funzioni.
Si tratta, appunto, di molecole molto conosciute e studiate dalla Biologia Molecolare, che le definisce signaling (messenger) molecules, sostanze in grado di portare alla diverse cellule dell’organismo le “istruzioni corrette” per il loro ottimale funzionamento.
Sono i neuropeptidi, gli ormoni, le citochine.
A queste si affiancano i fattori di crescita, molecole fondamentali di regolazione e stimolo tissutale.
Le signaling molecules e il network P.N.E.I.
A partire dai primi anni ’70, la Ricerca nel campo della Fisiologia e della Biologia Molecolare ha evidenziato il ruolo cruciale delle signaling molecules in tutti i processi fisiologici e patologici. È riconosciuto a queste sostanze un ruolo decisivo nel determinismo dello stato di salute o di malattia ed è oggi acclarato che ogni patologia sia l’espressione di mutate concentrazioni, in eccesso o in difetto, di queste sostanze; tutta la ricerca mondiale in campo medico sta indirizzandosi verso lo studio delle signaling molecules, da cui dipende il destino in senso positivo (guarigione) o negativo (malattia) di molte condizioni patologiche, e la possibilità del loro utilizzo a scopo terapeutico.
Di pari passo con le acquisizioni sulle signaling molecules, negli ultimi anni si è assistito, in campo medico, al progressivo abbandono della concezione separazionistica e scotomizzata delle funzioni biologiche dell’organismo, per lasciare il posto ad una visione più unitaria, in conformità con i principi ispiratori della Psico-Neuro-Endocrino-Immunologia (P.N.E.I.) [1-4].
L’approccio P.N.E.I. rappresenta un vero cambiamento di paradigma in Medicina: dalla concezione strettamente biomedica e specialistica della salute e della malattia alla visione profondamente interdisciplinare.
Il principale elemento unificante del paradigma P.N.E.I. si esplicita nel cross-talk tra i Sistemi psico-neuro-endocrino ed il Sistema immunitario (Figura 1).
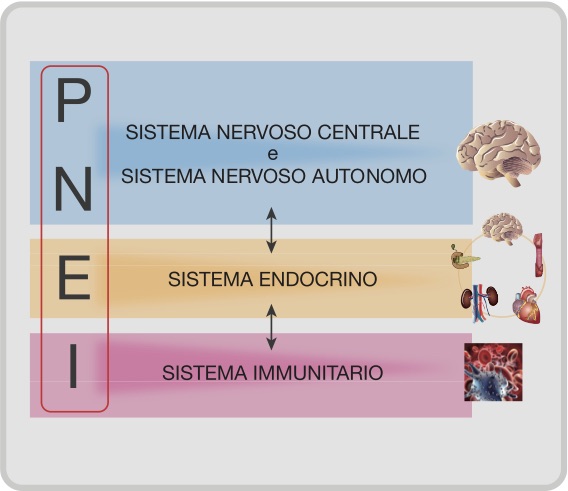
Questo complesso cross-talk è mediato da una rete complessa di signaling molecules (citochine, ormoni, neuropeptidi e fattori di crescita), veicolo delle informazioni biologiche necessarie per la regolazione complessa ed efficace delle risposte cellulari. Un alterato cross-talk, causato da uno squilibrio nella concentrazione (in eccesso o in difetto) di specifiche signaling molecules, è fondamentale, per esempio, nelle malattie infiammatorie, allergiche ed autoimmuni [5-7]; ripristinare la concentrazione fisiologica di molecole messaggere diviene il passaggio necessario per il recupero dell’equilibrio omeostatico fisiologico.
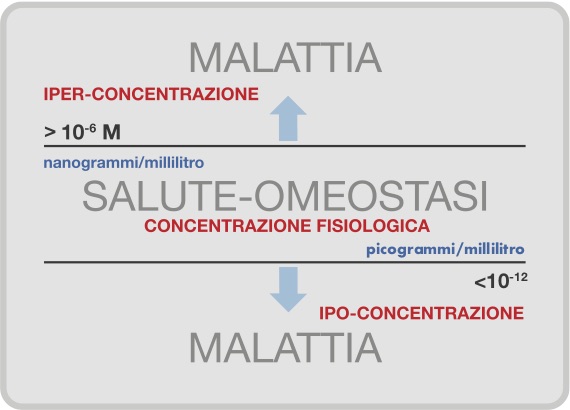
In condizioni di omeostasi (corrispondente allo stato di salute), le concentrazioni di queste molecole nella Extra-Cellular Matrix (ECM) sono comprese in un intervallo fisiologico specifico (nanogrammi-picogrammi) [8, 9]; le malattie possono essere considerate come espressione, conseguenza di mutate concentrazioni di queste molecole fondamentali [10-13] (Figura 2).
L’uso di molecole biologiche che controllano e guidano le funzioni cellulari, allo scopo di ripristinare le originarie condizioni fisiologiche, è il core della PRM.
Per la profonda comprensione della PRM è necessario considerare alcuni punti chiave relativi al cross-talk tra i Sistemi del network P.N.E.I. (e tra le cellule di questi) mediato dalle signaling molecules:
- Il cross-talk tra cellule, organi e Sistemi è sempre bidirezionale, così come gli effetti della sua alterazione [14-16].
- Il cross-talk intercellulare avviene attraverso la diffusione delle signaling molecules nella ECM: condizioni di alterazione patologica della ECM portano al deterioramento della qualità della comunicazione tra le cellule e, in generale, tra gli organi ed i Sistemi [17, 18].
- L’interazione ligando-recettore è cruciale per l’efficacia della trasduzione del segnale in termini di qualità e di intensità: parametri fondamentali sono concentrazione del substrato e proprietà come affinità e saturazione dei recettori [19, 20].
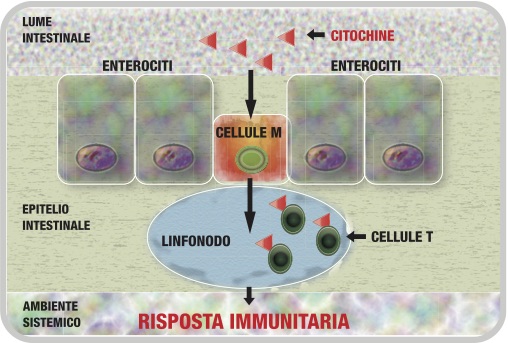
Le signaling molecules utilizzate in PRM vengono somministrate per via orale e la loro attività è sistemica (agiscono su complessi pathways intercellulari). La letteratura scientifica riporta che le citochine somministrate per via orale sono efficaci nel modulare la risposta immunitaria [21-23]; un possibile meccanismo d’azione coinvolge le cellule M a livello dell’epitelio intestinale: le molecole messaggere, dal lume intestinale, sono sequestrate dalle cellule M e presentate alle cellule T del Sistema immunitario, all’interno delle placche del Peyer [24], per indurre un’adeguata risposta immunitaria (Figura 3).
Quanto “low” deve essere una low dose (per essere efficace e sicura)?
Un punto critico relativo alla somministrazione orale delle signaling molecules (e di peptidi in generale) riguarda la loro bassa bio-disponibilità (tipicamente al di sotto del 1-2%); si impone, dunque, la necessità di un efficace drug delivery system per poter incrementare questo parametro chiave. L’utilizzo di bassi dosaggi fisiologici (nanogrammi-picogrammi) (Figura 2), somministrati per os, in PRM è reso possibile dall’applicazione della tecnologia farmaceutica denominata Sequential Kinetic Activation (SKA), un particolare e sofisticato drug delivery system, basato su principi di Fisica Quantistica (“release activity”: capacità della sostanza base di rilasciare nel mezzo acquoso la propria attività farmacologica) [25], che consente alle nano-concentrazioni di essere attive anche al di sotto di quella che attualmente è considerata la dose minima efficace, con effetti terapeutici comparabili a quelli indotti dagli alti dosaggi.
Il meccanismo d’azione delle low dose SKA di citochine, ormoni, neuropeptidi e fattori di crescita consiste nella sensibilizzazione di alcune unità di recettori cellulari (o plasmatici) in virtù della loro bassa concentrazione, il medesimo range di concentrazione al quale essi sono attivi in condizioni fisiologiche, tra 10-6 molare (microgrammi) per gli ormoni [8] e 10-12 molare (picogrammi) per le altre signaling molecules [9] (Figura 4). Questa sensibilizzazione recettoriale consente l’innesco di una serie di reazioni a catena (Sistemi complessi) ed il riavvio delle funzioni biologiche dell’intero network P.N.E.I.
Le molecole low dose SKA agiscono portando al Sistema l’informazione capace di indurre meccanismi di auto-regolazione.

Date queste premesse teoretiche, dal punto di vista clinico, gli approcci terapeutici sono:
- Recuperare l’omeostasi di un pathway cellulare patologicamente down-regolato attraverso la somministrazione della stessa citochina, ormone, neuropeptide o fattore di crescita (low dose SKA) fisiologicamente coinvolti nel signaling cellulare;
- Utilizzare molecule antagoniste (low dose SKA) per down-regolare le molecule patologicamente up-regolate, recuperando la loro concentrazione omeostatica, attraverso meccanismi di feed-back negativo, secondo il concetto di citochina o ormone “opponente”.
Poter correggere, ad esempio, le alterazioni del Sistema immunitario con l’uso delle citochine o le patologie endocrine con l’uso degli ormoni, rappresenta uno dei campi di ricerca più affascinanti ed innovativi della Biologia Molecolare applicata alla Medicina; ma l’applicazione clinica di queste conoscenze si è da sempre arenata contro lo scoglio degli effetti collaterali che queste sostanze evidenziano quando utilizzate ad alti dosaggi, quelli normalmente impiegati fino ad oggi.
Bio-Tech e low dose
Le più moderne biotecnologie nel campo della produzione di proteine ricombinanti umane hanno permesso ai ricercatori di realizzare farmaci di altissima qualità ed efficacia. I medicinali PRM low dose sono farmaci biotecnologici naturali basati su nano-concentrazioni di proteine ricombinanti umane. Le citochine, in particolare, sono per la maggior parte ricombinanti umane in Escherichia coli; ormoni, fattori di crescita, neuropeptidi sono ottenuti per la maggior parte per sintesi organica o sono di origine animale o ricombinanti umani.
Per questa nuova generazione di medicinali è fondamentale raggiungere una precisa e definita bassa concentrazione, nel range del sub-nanomolare. Grazie alla tecnologia farmaceutica SKA, consistente – essenzialmente – in un processo di rarefazione molecolare in mezzo acquoso, è possibile raggiungere concentrazioni corrispondenti a quelle presenti fisiologicamente nell’organismo umano.
Queste – definite nanoconcentrazioni di signaling molecules attivate secondo SKA – evidenziano risultati terapeutici assimilabili a quelli indotti dalle alte concentrazioni, senza gli effetti collaterali di queste ultime.
Il metodo SKA inaugura una nuova era nelle possibilità di utilizzo clinico delle signaling molecules ed il “sogno scientifico” di poter utilizzare molecole biologiche come citochine, ormoni, neuropeptidi e fattori di crescita a bassi dosaggi (gli unici possibili per non indurre effetti collaterali avversi) diventa oggi possibile grazie alla particolare procedura farmaceutica utilizzata nella produzione di queste molecole.
È nata e si sta sviluppando nel mondo una nuova frontiera nel campo dell’industria farmaceutica e della biologia molecolare. I ricercatori italiani e l’industria italiana sono all’avanguardia in questo settore.
Riferimenti bibliografici
- Ader R, Cohen N, Felten DL (1987) Brain, behavior, and immunity. Brain Behav Immun 1(1): 1-6.
- Ader R, Felten D, Cohen N (1990) Interactions between the brain and the immune system. Annu Rev Pharmacol Toxicol 30: 561-602.
- Ader R, Cohen N (1993) Psychoneuroimmunology: conditioning and stress. Annu Rev Psychol 44: 53-85.
- Ader R, Cohen N, Felten D (1995) Psychoneuroimmunology: interactions between the nervous system and the immune system. Lancet 345(8942): 99-103.
- Haroon E, Raison CL, Miller AH (2012) Psychoneuroimmunology meets neuropsychopharmacology: translational implications of the impact of inflammationon behavior. Neuropsychopharmacology 37(1): 137-62.
- Ngoc PL, Gold DR, Tzianabos AO, Weiss ST, Celedón JC (2005) Cytokines, allergy, and asthma. Curr Opin Allergy Clin Immunol 5(2): 161-6.
- Lourenço EV, La Cava A (2009) Cytokines in systemic lupus erythematosus. Curr Mol Med 9(3): 242-54.
- Vandenberg LN, Colborn T, Hayes TB, Heindel JJ, Jacobs DR Jr, et al. (2012) Hormones and endocrine-disrupting chemicals: low-dose effects and nonmonotonic dose responses. Endocr Rev 33(3): 378-455.
- Biancotto A, Wank A, Perl S, Cook W, Olnes MJ, et al. (2013) Baselinelevels and temporal stability of 27 multiplexed serum cytokine concentrations in healthy subjects. PLoS One 8(12):e76091.
- Reeves R, Leonard WJ, Nissen MS (2000) Binding of HMG-I(Y) imparts architectural specificity to a positioned nucleosome on the promoter of the human interleukin-2 receptor alpha gene. Mol Cell Biol 20(13): 4666-79.
- IshiharaK, Hirano T (2002) Molecular basisof the cellspecificity of cytokineaction. Biochim Biophys Acta 1592(3): 281-96.
- Commins SP, Borish L, Steinke JW (2010) Immunologic messenger molecules: cytokines, interferons, and chemokines. J Allergy Clin Immunol 125(2 suppl 2): S53-72.
- Bacchus W, Aubel D, Fussenegger M (2013) Biomedically relevant circuit-design strategies in mammalian synthetic biology. Mol Syst Biol 9: 691.
- Weigent DA, Blalock JE (1995) Associations between the neuroendocrine and immune systems. Journal of Leukocyte Biology 58(2): 137-150.
- HaddadJJ (2008) On the mechanisms and putative pathways involving neuroimmune interactions. Biochem Biophys Res Commun 370(4): 531-5.
- De la Fuente M (2014) Editorial: crosstalk between the nervous and the immune systems in health and sickness. Curr Pharm Des 20(29): 4605-7.
- Morrell NW, Adnot S, Archer SL, Dupuis J, Jones PL, et al. (2009) Cellular and molecular basis of pulmonary arterial hypertension. J Am Coll Cardiol 54(1 Suppl): S20-31.
- Bollyky PL, Bogdani M, Bollyky JB, Hull RL, Wight TN (2012) The role of hyaluronanand the extracellular matrix in islet inflammation and immune regulation. Curr Diab Rep 12(5): 471-80.
- Borroni EM, Mantovani A, Locati M, Bonecchi R (2010) Chemokine receptors intracellular trafficking. Pharmacol Ther 127(1): 1-8.
- Farrell MS, Roth BL (2013) Pharmacosynthetics: Reimagining the pharmacogenetic approach. Brain Res 1511: 6-20.
- Burnett AF, Biju PG, Lui H, Hauer-Jensen M (2013) Oral interleukin 11 as a countermeasure to lethal total-body irradiation in a murine model. Radiat Res 180(6): 595-602.
- Hanson ML, Hixon JA, Li W, Felber BK, Anver MR, et al. (2014) delivery of IL-27 recombinant bacteria attenuates immune colitis in mice. Gastroenterology 146(1): 210-221.
- Forster K, Goethel A, Chan CW, Zanello G, Streutker C, et al. (2012) An oral CD3-specific antibody suppresses T-cell-induced colitis and alters cytokine responses to T-cell activation in mice. Gastroenterology 143(5): 1298-307.
- Yun Y, Cho YW, Park K (2013) Nanoparticles for oral delivery: targeted nanoparticles with peptidic ligands for oral protein delivery. Adv Drug Deliv Rev 65(6): 822-32.
- O. I. Epstein. Release-Activity: A Long Way from Phenomenon to New Drugs. Bulletin of Experimental Biology and Medicine November 2012, Volume 154, Issue 1, pp 54-58
- Castiglioni S, Miranda V, Cazzaniga A, Campanella M, Nichelatti M, Andena M, Maier JAM. Femtograms of Interferon-γ suffice to Modulate the behavior of Jurkat cells: A new light in immunomodulation. Int. J. Mol. Sci. 2017;18:2715




